价格表
用途
定点突变导入(置换、缺失、插入)
说明
| 本品是利用KOD -Plus-高保真性,以Inverse PCR法进行位点特异性突变导入的试剂盒。本方法以质粒DNA为模板,使用反向设计的引物扩增质粒全长,进行突变导入。 |  |
特征
●导入突变的多样性
在正常突变导入的基础上,可进行数10bp的插入(如Tag的插入)及数百bp的缺失突变。另外,也可通过导入不同的碱基突变来创建氨基酸的点突变文库。
●导入突变的可靠性
最大可得到95%的突变导入效率。另外,将PCR错配产生的2nd-site mutation(目的突变以外的突变)的可能性降到最低。已确认对最长11kb的质粒进行了突变导入。
●操作简便
转化之前只要3步的简单步骤。另外,无需准备磷酸化引物。
原理
| 本试剂盒按以下顺序进行突变导入。 ①以Plasmid DNA为模板,使用突变导入引物进行Inverse PCR。如果想获得缺失突变体,在缺失区域的外侧设计引物。 接着,②向PCR产物中添加限制性内切酶Dpn I,消化模板质粒(Dpn I可以识别位点(GATC)中被甲基化的dA并进行酶切。因此,由于用一般的Dam甲基化酶(+)的大肠杆菌菌株(JM109、DH5α等)制备的质粒已被甲基化,Dpn I可以进行酶切)。最后,③直链质粒PCR产物通过自连进行环化,可用于大肠杆菌的转化。 | 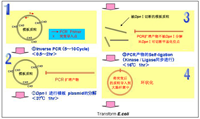 |
实验例
1.缺失及插入突变时效率的比较
以7.3kb的质粒FLJ32066为对象,使用本产品与A公司的non-PCR法试剂盒,进行90个碱基的缺失及6×His对应的18个碱基的导入。结果显示:用其他公司的试剂盒难于进行的缺失及插入突变导入,使用本产品时可以高效率地获得突变体。
2. 目的外突变(2nd-site mutation)的插入频率评价
以试剂盒附带的对照质粒(4.3kb)为模板进行突变导入(以8循环进行PCR),从得到的突变体中任意选取24个克隆,以2000bp长度分成几段分别进行测序。结果显示:使用本产品,在实际分析的总共48,000碱基中,只有一个目的以外的碱基发生突变。与A公司的non-PCR法试剂盒相比较,也是同等以上的效果。
KOD -Plus-
10x Buffer for iPCR
2mM dNTPs
Dpn I
T4 Polynucleotide Kinase
Ligation high
Control Plasmid
Control Primer #1
Control Primer #2
活性的定义:
在75℃活性测定条件下,在30分钟内摄入10nmoles的全核苷酸使成为酸不溶物时所需酶的活性定义为1U。
来源:
E.coli 重组体
●本试剂盒中使用的酶与KOD -Plus-相同。
●10×Buffer for iPCR是进行了最优化的本试剂盒专用buffer。
*各酶溶液(KOD -Plus-, Dpn I, T4
Polynucleotide Kinase)中,虽然含有属于消防法 危险物品 第4类 着火性液体 第3石油类水溶性液体的50%的甘油,但是在着火点测定试验中已确认不属于危险物品。
KOD-Plus-(1U/μl) 1μl
10×Buffer for iPCR 5μl
2mM dNTPs 5μl
Forward Primer 15pmoles
Reverse Primer 15pmoles
模板Plasmid DNA 50ng
------------------------
Total Volume 50μl
Cycle
94℃, 2min.
↓
98℃ 10sec.
68℃ Xmin. 4〜10 Cycles
●Primer的设计 从这里可以看到。所用的引物无需磷酸化。
●质粒模板 一般使用JM109、DH5α等大肠杆菌制备的质粒。Dam甲基化酶(-)菌株制备的质粒不能使用。
参考文献
(1)S. Arai et al., FEBS Letters, 581(29): 5649-5657(2007)
(2)Y. Torisu et al., Cancer Science,99(6): 1139-1146(2008)
(3)N. Shinmen et al., FEBS Letters.583(12): 1916-1922(2009)








