价格表
用途
多重PCR
亚硫酸氢盐处理的DNA的扩增
说明
特征
●均一地扩增(低偏差)
可以在1 kb以下的短片段至10 kb左右的长链目的片段这一广范围内进行高特异且均一性的多重PCR。将因GC偏差引起的对扩增的影响降到了最低程度、可均一地扩增基因组及转录组的各种区域的片段。
利用这一特性,可制备用于下一代测序分析的扩增产物。
●含有较多尿嘧啶DNA的扩增
可对亚硫酸氢盐处理后的含有较多尿嘧啶的DNA进行高效率地扩增。已确认最大可扩增约1.5 kb。
●可使用含有I或U的引物
以前的高保真性PCR酶,使用含有I或U的引物时扩增困难,KOD -Multi & Epi- 则可以使用这类引物进行分析。
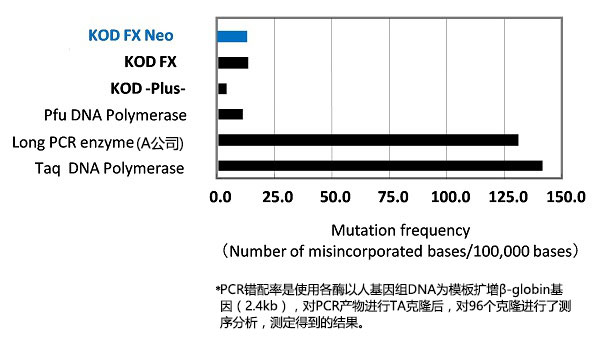
●高保真性
是Taq polymerase保真性的11倍(与KOD FX Neo相同),扩增产物可用于各种用途。
●可扩增粗样品
不易受粗样品的影响,比如使用血液样品,还可对动植物的裂解物进行基因分型,甚至对土壤、食品样品等进行扩增。
●高效率
因为添加了延伸增强剂,提高了PCR效率,单重PCR最短延伸时间可以缩短到15 sec./ kb。
※粗样品、使用亚硫酸氢盐处理的DNA样品及进行长链多重PCR时,为了提高效率,延伸时间推荐设为30~60 sec./ kb。
实验例
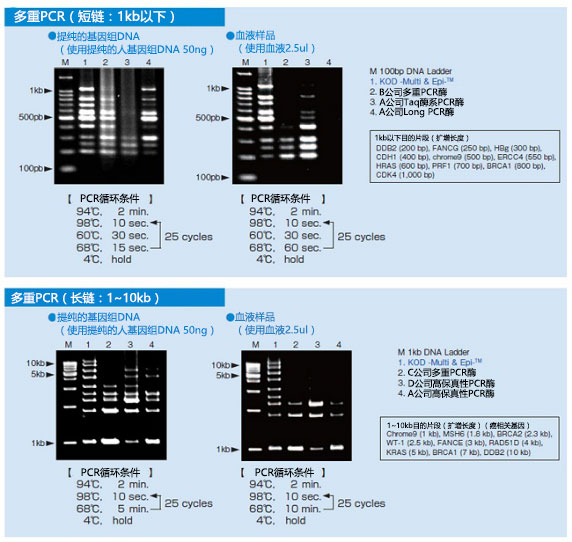
1. 多重PCR性能比较
使用纯化的人基因组DNA及血液样品,对1kb以下及1~10kb的多数的目的片段,用各种PCR酶进行多重PCR性能的比较(50ul反应体系)。结果显示,只有使用KME时,才能在所有的条件下得到偏差性低的良好结果。KME不易受血液成分的抑制,可以得到与用纯化的基因组DNA扩增相同的偏差小的扩增结果。
2. 使用NGS对长链(10kb)目的片段的多重扩增时偏好性的验证
用6种PCR试剂对10种10kb的目的片段(其中5种目的片段的GC含量在70%的区域含有300bp以上的长度)进行扩增,将确认能扩增的试剂的PCR产物纯化后用Covaris®片段化,使用Truseq® nano LT kit制备文库,使用Miseq®(illumina)进行测序分析。以Read数最多的目的基因为基准(1.0),将各个Read数的比值作成图。
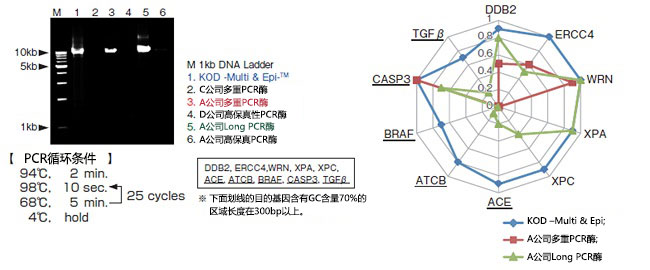
电泳结果显示,虽然泳道3,5中用A公司的试剂也得到了良好的扩增,但是NGS分析的结果中,产生了扩增偏好性。另一方面,KME在10种目的基因中,因为Read数的比值在0.6~1.0之间,可见均一性良好。
3. 亚硫酸氢盐处理过的DNA的扩增效率的比较
没甲基化的C用亚硫酸氢盐处理后转变成U,通过PCR测序分析,就可以与甲基化的C区别开。通过这样处理,目的片段序列中的AT含量变高,另外因为被片段化后,通常亚硫酸氢盐处理过的DNA的扩增比较困难。

以亚硫酸氢盐处理过的Jurkat细胞来源的甲基化DNA(55ng)为模板,用各种DNA聚合酶扩增900~1500bp的片段进行比较。结果显示,大约1.5kb以内的目的片段,用KME都能得到一个良好的扩增结果。然后进一步对于1583bp的扩增产物,使用克隆试剂盒(Target Clone-Plus-)进行克隆之后,进行测序分析,可以确认亚硫酸氢盐处理过的目的片段也得到了扩增(数据没有在此出示)。

另外,对于TGF (917bp),进行模板量的探讨。结果显示,可以检测到最低5ng的量。通过亚硫酸氢盐处理可以使DNA片段化,KME对于这样处理过的样品,也可以高灵敏度地检测到约1kb的目的片段。

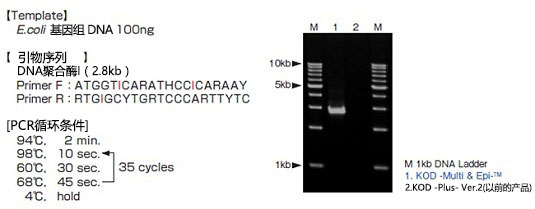
4. 含有次黄苷酸(I)的引物扩增效率的比较
根据E.coli 的DNA聚合酶Ⅰ的氨基酸序列设计含次黄苷酸(I)的兼并引物,用KME和KOD-PLUS- Ver.2(原来的产品)进行扩增。
结果显示,通过使用KME,可使用用原来的KOD DNA聚合酶等高保真性PCR酶不能使用的含有I的兼并引物进行扩增。同样也可使用含U的引物进行扩增。
KOD -Multi & Epi-(1U/μl)200μl×1支
2×PCR Buffer for KOD -Multi & Epi-1.7 ml×3支※50μl反应体系的情况下可使用200次。
※2×PCR Buffer for KOD -Multi & Epi-中含有dNTPs(dATP、dGTP、dCTP、dTTP)及Mg2+(终浓度2.0mM)。
*酶溶液中虽然含有消防法危险物 第4类 易燃液体 第3石油类 属于水溶性液体的50%的甘油,但是已确认在着火点测试实验中不属于危险物。
(1)单重PCR反应条件
灭菌蒸馏水Xμl
2×PCR buffer for KOD -Multi & Epi-
25μl
10pmol/μl Primer F1.5μl
10pmol/μl Primer R1.5μl
模板~200ng(Genomic DNA)
~50ng(Plasmid)
~200ng〔RNA相当〕(cDNA)
~5μl(粗样品)
KOD -Multi & Epi-(1.0U/μl)1μlTotal Volume50μl〈2步法循环〉
[引物Tm值高于65℃时]
94℃, 2min.
↓
98℃, 10sec.
68℃, 15~60sec./kb 30 cycles
Cycle(2)
〈3步法循环〉
[引物的Tm值低于65℃时]
94℃, 2min.
↓
98℃, 10sec.
Tm℃, 10sec.
68℃, 15~60sec./kb 30 cycles
(2)多重PCR反应条件
灭菌蒸馏水Xμl
2×PCR buffer for KOD -Multi & Epi-
25μl
10pmol/μl Primer F1.5μl
10pmol/μl Primer R1.5μl
模板Genomic DNA ~200ng
Plasmid DNA ~50ng
cDNA ~200ng(RNA相当)
粗样品~5μl
KOD -Multi & Epi-(1.0U/μl)1μlTotal Volume50μl〈2步法循环〉
[引物的Tm值高于65℃时]
94℃, 2min.
↓
98℃, 10sec.
68℃, 15~60sec./kb 25 cycles
Cycle(2)
〈3步法循环〉
[引物的Tm值低于65℃时]
94℃, 2min.
↓
98℃, 10sec.
Tm℃, 30sec.
68℃, 15~60sec./kb 25 cycles
(3)使用亚硫酸氢盐处理的DNA进行PCR的反应条件
反应液组成
灭菌蒸馏水Xμl
2×PCR buffer for KOD -Multi & Epi-
25μl
10pmol/μl Primer F1.5μl
10pmol/μl Primer R1.5μl
亚硫酸氢盐处理DNA ~200ng
KOD-Multi & Epi-(1.0U/μl)1μlTotal Volume50μlCycle
〈3步法循环〉
94℃, 2min.
↓
98℃, 10sec.
Tm℃, 30sec.
68℃, 15~30sec./kb 40 cycles
※Tm值采用最邻近法(Nearest Neighbor method)计算得到的值。
引物的Tm值以及扩增产物的Tm值计算请点击此处进入在线工具