价格表
用途
PCR
说明
特征
●优良的保真性(本公司同类产品中为第一)
KOD DNA polymerase的特点是具有非常高的保真性,而KOD –Plus-的保真性有了更大的提高。大约为Taq DNA polymerase的80倍。最适用于克隆。
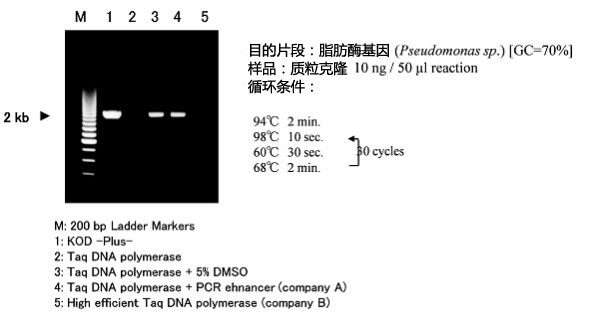
●通过热启动提高了PCR反应效率
通过将2种抗KOD单克隆抗体预混在酶中,抑制了常温状态下的多聚酶活性(该活性是产生非特异性反应的主要原因)和3'→5'核酸外切酶活性。抗体在PCR的预变性步骤即发生失活,对扩增反应没有任何影响。
●延伸性・扩增效率的提高
对反应Buffer的组分进行了优化,使之较以往的KOD DNA Polymerase延伸性・扩增效率均有很大的提高。
●超群的耐热性
因其耐热性比Taq DNA Polymerase更为优良,故可以将热变性步骤的温度设定值提高,对GC含量高,容易形成高级结构的目的片段尤其适用。
●高PCR成功率【KOD -Plus- Ver.2】
对难扩增的目的片段、长目的片段的PCR成功率比KOD -plus-更高。另外,也降低了带入的逆转录反应液对PCR反应的抑制。
实验例
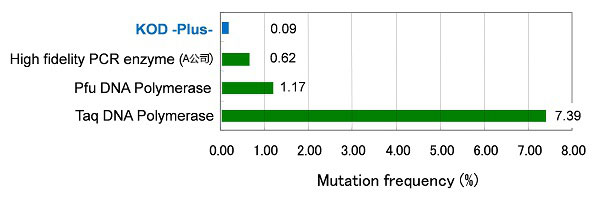
1. 各公司PCR酶的保真性
关于PCR保真性,与其他公司PCR酶相比,可得知KOD -plus-的保真性最高。
该保真性为Taq DNA Polymerase的约82倍。
|
2. 与其他公司高保真性PCR酶在PCR扩增性能方面的比较
以Human β-globin基因3.6kb为目的片段,用KOD -Plus-及其他公司的高保真性PCR酶进行扩增并比较。
结果可见,与其他公司的High Fidelity酶相比较,KOD -Plus-显示了良好的扩增效果。
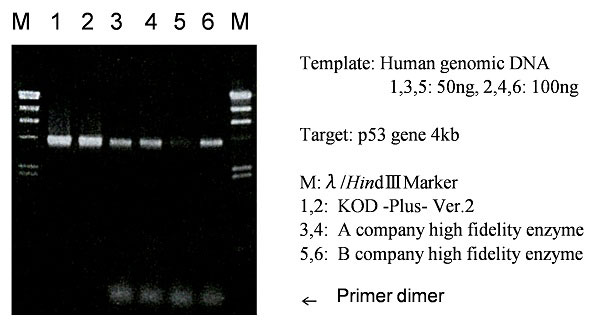
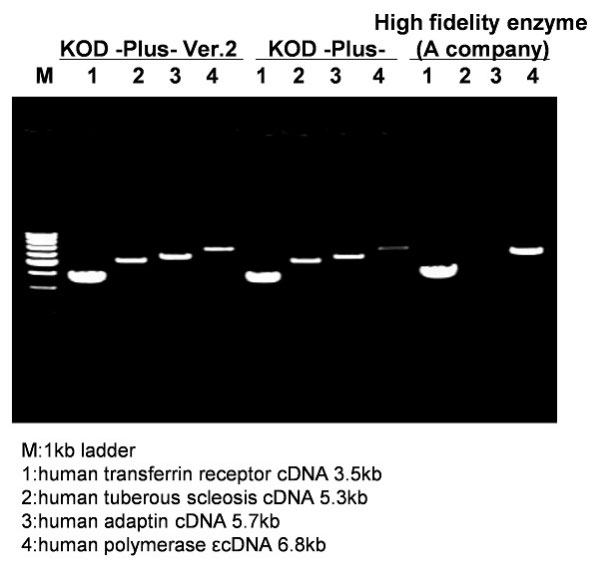
3.用各种cDNA为目的片段与其他公司PCR用酶在PCR扩增性能方面的比较
以HeLa total RNA逆转录的cDNA为模板,对4种目的片段进行PCR并比较其效率。
结果可见,与其他酶相比,KOD -Plus- Ver.2显示了良好的扩增效果。特别是对难扩增的6.8kb的目的片段,也能得到明亮的扩增条带。
【KOD-201】
KOD -Plus-(1U/μl)*200μl ×1支
10×PCR Buffer [KOD-2B]1.0ml ×1支
25mM MgSO4 [KOD-2S]1.0ml ×1支
2mM dNTPs [NTP-201]1.0ml ×1支
【KOD-211】
KOD -Plus-(1U/μl)*200μl ×1支
10× PCR Buffer [KOD-3B]1.0ml ×1支
25mM MgSO4 [KOD-2S]1.0ml ×1支
2mM dNTPs [NTP-201]1.0ml ×1支
*含有1.6μg/μl 浓度的KOD抗体。
组分:
50mM Tris-HCl(pH8.0)
0.1mM EDTA
1mM DTT
50% Glycerol
0.001% Tween® 20
0.001% Nonidet® P-40
活性的定义:
在75℃活性测定条件下,在30分钟内摄入10nmoles的全核苷酸使成为酸不溶物时所需酶的活性定义为1U。
来源:
E.coli 重组体
〈KOD -Plus-〉
10×PCR Buffer(KOD -Plus-用)5μl
25mM MgSO42μl(1mM)
各Primer15pmoles each
2mM dNTPs5μl(0.2mM)
模板1〜50ng(Plasmid)
10〜200ng(Genomic DNA)
〜1μl(逆转录反应液)
KOD -Plus-(1U/μl)1μl(1U)Total Volume50μl
< 3 Step Cycle >*
94℃ 2min.
↓
94℃ 15sec.
Tm-5℃ 30sec.68℃ 1min./kb 25〜35 cycles
< 2 Step Cycle >*
94℃ 2min.
↓
94℃ 15sec.68℃ 1min./kb 25〜35 cycles
〈KOD -Plus- Ver.2〉
10×PCR Buffer(KOD -Plus- Ver.2用)5μl
25mM MgSO43μl(1.5mM)
各Primer15pmoles each
2mM dNTPs5μl(0.2mM)
模板1〜50ng(Plasmid)
10〜200ng(Genome DNA)
〜2μl(逆转录反应液)
KOD -Plus-(1U/μl)1μl(1U)Total Volume50μl
< 3 Step Cycle >*
94℃ 2min.
↓
98℃ 10sec.
Tm-5℃ 30sec.68℃ 1min./kb 25〜40 cycles
< 2 Step Cycle >*
94℃ 2min.
↓
98℃ 10sec.68℃ 1min./kb 25〜40 cycles
*通常用3步法进行扩增。
引物的Tm值在72℃以上时,如果用3步法循环出现smear现象,改用2步法循环有时会改善。
※Tm值采用最邻近法(Nearest Neighbor method)计算得到的值。引物的Tm值以及扩增产物的Tm值计算请点击此处进入在线工具
●关于PCR与PCR相关技术、选择DNA Polymerase的指标、各PCR用Polymerase的性质、Exonuclease活性、TdT活性、热启动技术、改良Buffer提高技术性能、trouble shooting等,本公司使用本酶做了的一系列实验例。
如有需求,请跟我们本公司或代理商联系。
※本酶的10×PCR Buffer是本产品专用的。与KOD DNA Polymerase的Buffer组分是不同的。
●PCR产物的克隆
由于本酶的PCR产物已被平滑化,可用平滑末端克隆法进行克隆。此时,如已对载体进行了脱磷酸化处理,就需要对PCR产物进行磷酸化,或使用带5'磷酸基的引物。
另外,由于本酶的PCR产物已被平滑化,不能直接进行TA克隆。可使用按以下方法开发的TA克隆专用试剂盒「TArget Clone -Plus-」。
●PCR条件的设定
酶的标准使用量为50μl反应体系1U。延伸反应在68 ℃条件下进行,按1kb/1min.的标准。出现拖尾条带时,可降低MgSO4浓度,无法确认到扩增时,可提高MgSO4浓度。
●高GC含量的模板
在反应液中添加终浓度为2〜5%的DMSO可得到改善。
●以RT反应液为模板的情况
过量带入RT反应液有可能会对PCR反应产生抑制作用。建议带入到PCR的RT反应液在PCR反应液的1/25以下(最好在1/50以下)。这样就无需考虑RT反应液中Mg2+、dNTPs的影响,只要按照基本反应条件添加本酶中添付的dNTPs和MgSO4即可。
●引物的设计
3'端有错配的引物,可能会受到本酶校正。
FAQ请点击这里
参考文献
1) J. Mo et al., J. Mol. Biol., 222: 925-936(1991)
2) M. Takagi et al., Appl. Environ. Microbiol., 63: 4504-4510(1997)
3) H. Hashimoto et al., J. Biochem.(Tokyo),125: 983-986(1999)
4) H. Mizuguchi et al., J. Biochem.(Tokyo),126: 762-768(1999)
5) H. Hashimoto et al., J. Mol. Biol.,306: 469-477(2001)
6) M. Watanabe et al., J. Biochem.(Tokyo),131: 183-191(2002)
7) H. Terasaki et al., Intl. J. Mol. Med., 9: 107-112(2002)
相关产品
●(单独销售的组分)
| 品名 | Code No. | 包装 | 价格 | 保存温度 | 说明书 |
|---|---|---|---|---|---|
| NTP-201 | 1.0ml | RMB 65 | -20℃ | -- |
●●使用KOD -Plus-的RT-PCR试剂盒
| 品名 | Code No. | 包装 | 价格 | 保存温度 | 说明书 |
|---|