价格表
用途
Realtime RT-PCR
说明
特征
● 迅速・高灵敏度
通过使用Probe的One-step qRT-PCR,可迅速且高灵敏度地对微量RNA进行定量。
● 序列偏差的降低
不易受目的基因序列的影响,可高灵敏度地检测出各种各样的RNA。
将多重检测(Multiplex)时各目的基因扩增的偏差降至最低。
●混杂物抗性的提高
可避免因血红素等的PCR抑制剂导致的灵敏度下降。
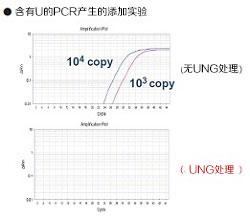
●使用dUTP
通过添加Uracil-N-Glycosylase(UNG)*,能够防止因Carryover污染而导致的假阳性发生。
* 本产品中不含有UNG。
原来的一步法的缺点 | 本试剂盒的改良点 |
●引物的优化比较困难 【高灵敏度比较困难】 ●容易产生因序列而导致的测定灵敏度偏差 | ●将因引物、探针或目的片段序列而引起的扩增偏差性影响抑制到了最小限度 →有利于各种各样的病毒及mRNA的迅速、高灵敏度检测或定量 |
●容易因RNA中的混杂物而引起灵敏度下降 | ●能够避免因混杂物引起的抑制 |
●用TaqMan probe法难于进行多荧光分析 | ●将多重检测中各目的片段扩增的偏差抑制到了最低限度 →最适于以管家基因作为对照的多数基因的相对定量等 |
实验例
1. 肠道病毒RNA的高灵敏度检测
将肠道病毒RNA作4倍稀释,使用TaqMan probe法,与其他公司的产品比较检测灵敏度及定量性。引物、TaqMan probe是直接使用论文记载的序列(没有进行优化处理)。用Applied Biosystems®、StepOnePlus™进行分析。
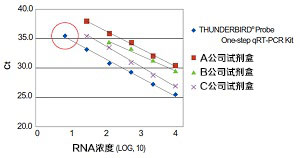
2. 各种病毒检测灵敏度的比较
制备11种病毒RNA的4倍稀释系列溶液,使用TaqMan probe法,进行最高检测灵敏度的比较。引物、TaqMan probe是直接使用论文记载的序列。用Applied Biosystems®、StepOnePlus™进行分析。
将各试剂能检测到的最低拷贝数连线作图。
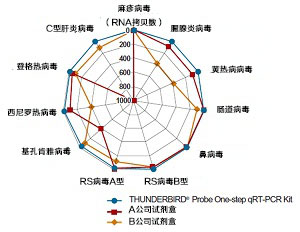
结果显示:只有用本试剂盒时,才能对所有的目的基因以30个拷贝以下的灵敏度进行检测及定量。通过这个实验表明,本试剂不受目的片段序列的影响,能以高灵敏度检测到各种各样的RNA。
3. 多重荧光检测(Multiplex)体系中的表达定量
使用三种荧光标记的TaqMan探针,分别用单独检测及一次使用三种TaqMan探针的多重荧光检测体系,分析IL-1β、TNF-α、GAPDH基因的表达量。
实验中以HeLa S3 RNA(1pg~100ng的10倍稀释【6个梯度】)为样品,用Roche Diagnositics公司的LightCycler 96进行分析。
结果显示,各基因用单独(图1)及使用三通道的多重荧光检测(图2)分析中得到了相同的灵敏度,PCR效率及相关系数并没有太大的差异(表1)。
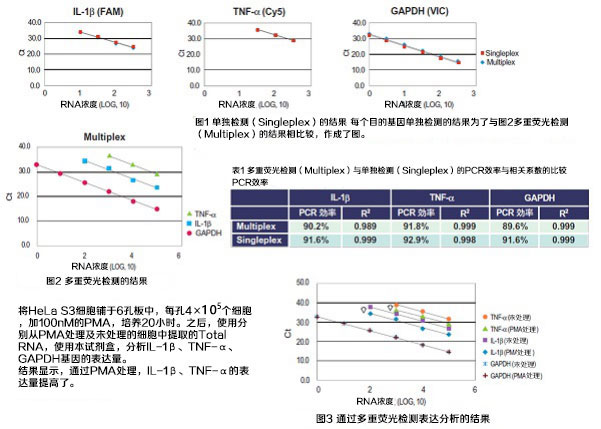
4. 使用临床检测样本的RS病毒A型、B型的同时定量
使用从20个检测体的咽喉粘液中提取的RNA样品,用RT-PCR法及使用THUNDERBIRD One-step qRT-PCR试剂盒的qRT-PCR,进行RS病毒的检测。
另外,同时与用抗体检测方法进行分析的结果进行比较。
为了判断RS病毒的A型和B型,使用特异的引物及各种不同荧光标记的TaqMan探针,用qRT-PCR进行定量分析。
用Roche Diagnositics公司的LightCycler 96进行分析。结果显示,抗体检测法中判定为假阴性的检测体,用PCR法可以高相关性地判定有无感染。另外,类型判定结果也完全一致。
使用各种不同的方法对RS病毒的检测相关试验结果
检测体编号 | 抗体检测方法 | PCR(定性、类型判定) | qPCR分析的定量值(拷贝数) | |
A型检测(FAM, 470nm) | B型检测 (Cy5, 645nm) | |||
1 | + | +(A) | 1.6×105 | - |
2 | - | - | - | - |
3 | + | +(A) | 8.1×104 | - |
4 | + | +(A) | 2.7×105 | - |
5 | - | +(A) | 9.6×102 | - |
6 | - | +(A) | 3.6×103 | - |
7 | + | +(A) | 2.3×106 | - |
8 | - | - | - | - |
9 | + | +(A) | 1.5×105 | - |
10 | + | +(A) | 6.7×105 | - |
11 | - | - | - | - |
12 | + | +(A) | 1.6×105 | - |
13 | + | +(A) | 9.4×103 | - |
14 | - | +(A) | 9.5×103 | - |
15 | + | +(A) | 3.9×105 | - |
16 | + | +(A) | 2.4×105 | - |
17 | - | - | - | - |
18 | - | +(A) | 4.2×104 | - |
19 | - | +(A) | 3.4×102 | - |
20 | - | +(A) | - | 9.6×103 |
【QRZ-101】
2× Reaction Buffer1.25ml ×2支
DNA Polymerase125μl
RT Enzyme Mix125μl
50× ROX reference dye100μl
2× Reaction Buffer1.25ml ×2支
(50μl体系100次,或20μl体系250次)
【QRZ-101S】
2× Reaction Buffer500μl
DNA Polymerase25μl
RT Enzyme Mix25μl
50× ROX reference dye*20μl
2× Reaction Buffer500μl
(50μl体系20次,或20μl体系50次)
*ROX溶液是另外添加的,可以对应几乎所有的荧光定量PCR检测仪器。
RNase free waterXμl
2×Reaction Buffer25μl
DNA Polymerase1.25μl
RT Enzyme Mix1.25μl
Forward Primer25pmol
Reverse Primer25pmol
TaqMan® probe10pmol
RNA溶液Yμl
50× ROX Reference dye*11/0.1μl
(Uracil-N-Glycosylase1unit*2)
*1 50×ROX reference dye,是对于使用 Passive Reference 的仪器(如Applied Biosystems 公司制造的仪器等),为校正各孔间的荧光强度及分注误差而使用。不用 Passive Reference 进行校正的仪器无需添加。
*2 使用Uracil-N-Glycosylase(UNG)处理时,请使用热敏性(heat-labile)UNG。可根据各公司推荐的条件,调整酶的用量。
Cycle
(20~25℃ 10min.*3)
↓
50℃ 10min.
↓
95℃ 1min.
↓
95℃ 15sec.
60℃ 45sec. 40~45 cycles
*3 进行UNG处理时,请在逆转录反应前,设定UNG反应步骤。上述表示的是一般温度条件及反应时间,请根据各公司的推荐条件进行调整。
防止因携带污染(carryover)而产生的假阳性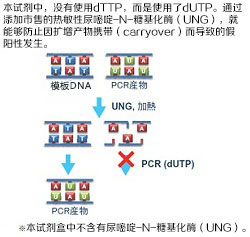
本产品是得到Chakrabarti Advanced Technology NewCo LLC.公司US7772383专利的授权进行销售的。
相关产品
●●RNA制备相关的试剂及用具
| 品名 | Code No. | 包装 | 价格 | 保存温度 | 说明书 |
|---|










